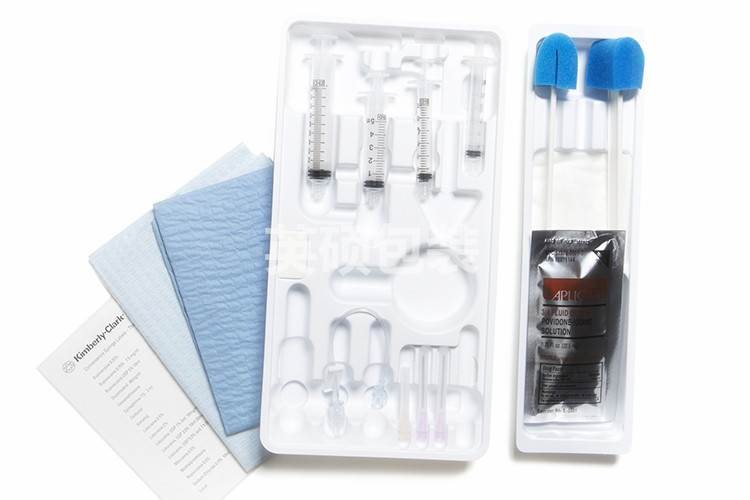
医疗器械灭菌包装密封性验证参考标准
随着医疗器械对灭菌包装需求的不断扩大,质量和安全检验性也变得越来越严格。医疗器械灭菌包装(吸塑盒+特卫强盖材、纸塑袋等)作为直接与器械接触且用于阻隔微生物的一种包装形式。无论是何种形式的包装,都具备两个特性,可以满足灭菌操作并且在运输条件未使用前保持无菌状态。因此,相关部门开始重点加强关注灭菌包装的评审要求并且对其性能与质量做出具体的要求。
众所周知,现行的灭菌包装标准中,GB/T19633-2005《最终灭菌医疗器械的包装》是公认指导的权威标准之一。它与ISO11607-2003《最终灭菌医疗器械的包装》等同。明确灭菌包装应满足的基本性能要求:原材料的生物相容性、化学毒理性、微生物屏障、密封闭合性、老化性等。这其中所提及到的密封性是影响整个无菌屏障系统的关键因素,它的失效将意味着无菌状态被破坏,且很大程度上引发医疗事故。
GB/T19633-2005《最终灭菌医疗器械的包装》里明确规定密封强度为不可忽略的安全验证项目之一。提出的两种测试方法分别为:拉伸密封强度试验和胀破/蠕变试验。灭菌包装的拉伸密封试验主要是通过拉力来测试其的密封强度。胀破/蠕变试验是通过向包装内加压至破裂点或加压至临界点并保持一段时间来评价灭菌包装总体最小密封强度。由于标准中并未对此方法进行详细描述,有需要的可参考ASTM F 1140、YY/T 0681及ASTM F 8806等标准 。
——责任编辑:英硕包装
版权所有http://www.yinso.com.cn转载请注明出处
相关推荐:
最新产品
同类文章排行
- 影响环氧乙烷灭菌效果的因素
- 无菌包装材料的评估项目及测试方法参考
- 影响医疗器械货架有效期的因素
- 《医疗器械初包装的生产环境要求》
- 《最终灭菌医疗器械包装合规标准参考》
- 疫情期间,医用吸塑托盘整柜发往国外
- 开发与设计医疗包装要遵循哪些基本步骤
- 提供医疗器械吸塑盒时不可忽视的灭菌通道设计
- 医疗器械包装必备的三个基础条件
- 目力检测医用包装的密封完整性
最新资讯文章
您的浏览历史